- Mary Johnson Ph. D.mary at labome dot comSynatom Research, Princeton, New Jersey, United States
- Galet Colette Ph. D.cogalet at gmail dot comUniversité de Californie à Los Angeles, États-Unis
Les détergents utilisés dans les laboratoires de biologie et de biochimie sont des tensioactifs doux utilisés pour la lyse des membranes cellulaires et la dissolution du matériel intracellulaire en une forme soluble. Leurs applications principales sont la dissociation des interactions protéine-protéine, protéine-lipide et lipide-lipide, la dénaturation de la structure protéique et la prévention des liaisons non spécifiques dans les approches immunochimiques et de cristallisation de protéines. Plusieurs types de détergents existent et sont regroupés selon leurs propriétés. Le choix d’un détergent est crucial et dépend de l’application qui suit la lyse cellulaire.
Il existe plusieurs types de détergents. Les nouveaux détergents, généralement utilisés pour des applications spécifiques, sont développés continuellement [1]. Dans cette revue, certains des détergents les plus communs sont décrits ainsi que leurs caractéristiques et applications.
| Type | Agent Chimique |
|---|---|
| ionique | sodium dodecyl sulfate (SDS), desoxycholate, cholate |
| non-ionique | triton X-100, DDM, digitonine, tween 20, tween 80 |
| zwitterionique | CHAPS |
| Chaotropes | urée |
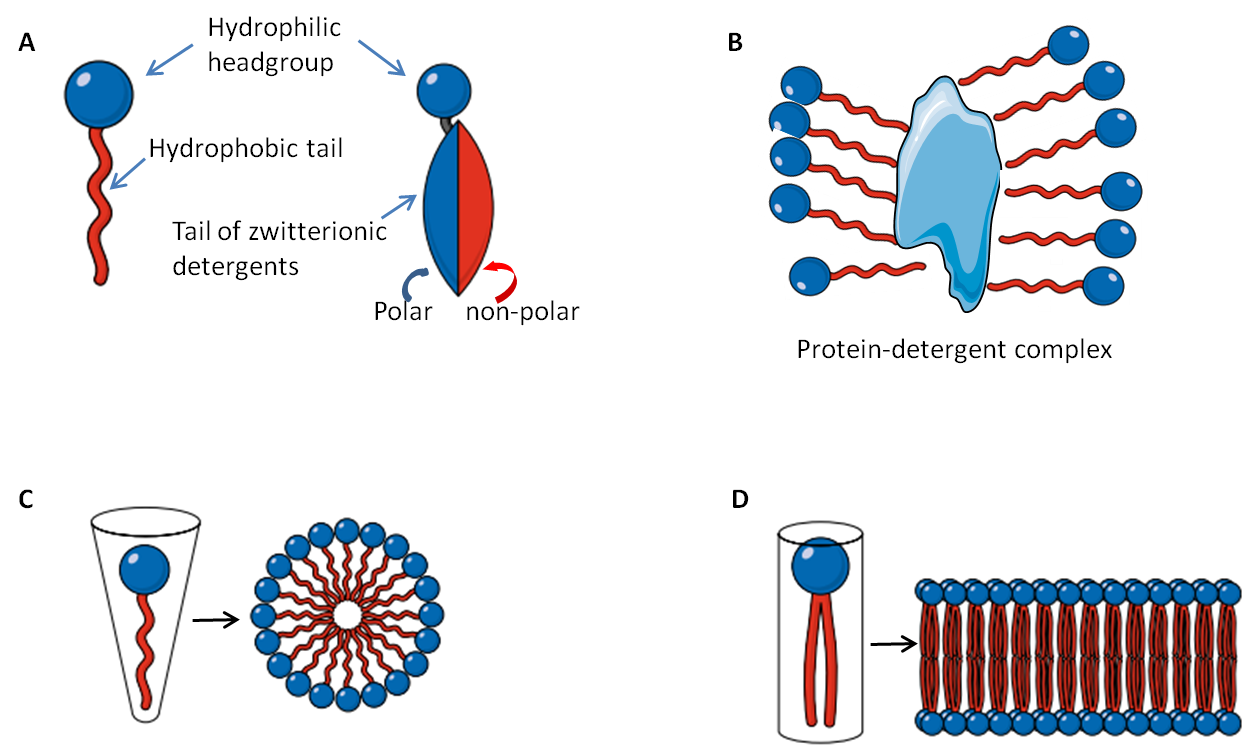
Les détergents sont des composés organiques comprenant un groupement hydrocarboné hydrophobe et une extrémité chargée ou hydrophile (Fig. 1A). Après dissolution dans l’eau, à une concentration et une température données, les molécules de détergents forment des micelles présentant la partie hydrophobe à l’intérieur de la micelle et l’extrémité hydrophile à l’extérieur (Fig. 1B). Par conséquent, le centre hydrophobe de la micelle se lie aux régions hydrophobes des protéines. Le nombre de molécules de détergent par micelle donne le nombre agrégation qui est un paramètre important utilisé pour déterminer la solubilité des protéines membranaire [2]. La longueur de la chaine hydrophobe est directement proportionnelle au degré d’hydrophobicité et est relativement constante parmi les détergents alors que l’extrémité hydrophile est variable. Les détergents sont d’ailleurs classifiés en trois groupes en fonction des caractéristiques de leur extrémité hydrophile: ionique (anionique et cationique), zwitterionique et non-ionique. La concentration minimale de détergents à laquelle des micelles sont observées à une température définie est appelée Concentration Micellaire Critique (CMC). A des concentrations inférieures à la CMC, seuls des monomères sont observés alors qu’à des concentrations supérieures à la CMC, micelles et monomères coexistent avec d’autres phases non micellaires qui ne sont pas dissoutes dans l’eau. De même, la plus faible température à laquelle des micelles sont observées est appelée Température Micellaire Critique (TMC). Donc, la température et la concentration sont deux paramètres importants pour la phase de séparation et la solubilité d’un détergent. La CMC est aussi affectée par le degré de lipophilicité de l’extrémité hydrophile. Généralement, une faible lipophilicité ou un caractère lipophobe conduit à une CMC élevée.
Les détergents ioniques sont formés d’une chaine hydrophobe et d’une extrémité hydrophile chargée qui peut être un anion ou un cation. Généralement, ils présentent une CMC plus élevée que les détergents non-ioniques. Ces détergents sont abrasifs.
Sodium dodecyl sulfate (SDS) – le SDS, anionique, est un surfactant très efficace pour la solubilisation de presque toutes protéines. Il détruit les ponts non-covalents des protéines, les dénaturant de telle sorte qu’elles perdent leur conformation originale et leur fonction. Le SDS se lie aux protéines avec un ratio de 1.4:1 w/w (ou un anion SDS pour deux acides aminés) et de cette façon, masque la charge des protéines et ajoute une charge négative aux protéines dans l’échantillon malgré leur point isoélectrique (pI). C’est la raison pour laquelle le SDS est largement utilisé en électrophorèse dénaturante sur gel de polyacrylamide (SDS-PAGE). Généralement pour une lyse cellulaire complète, l’échantillon doit être traité aux ultrasons à l’aide d’un sonicateur ou passé plusieurs fois au travers d’une aiguille (19G) pour assurer la dégradation de l’ADN. Le SDS dénature les protéines et détruit leur structure 3D, de ce fait, il ne doit pas être utilisé quand des protéines actives sont nécessaire ou quand les interactions protéine-protéine sont étudiées. Des précautions supplémentaires doivent être prises lorsque des détergents ioniques sont utilisés car certaines de leurs propriétés peuvent être modifiées dans des solutions tampons avec des forces ioniques variables (e.g. CMC diminue de 0.5 à 8 mM quand la concentration en NaCl augmente de 0 à 500 mM). De plus, le SDS va précipiter à basse températur, à cause de sa TMC qui est l’une des plus élevée parmi les détergents. Cet effet est augmenté en présence de sels de potassium. Ce phénomène peut être exploité pour éliminer le SDS des échantillons de protéines [3].
Le desoxycholate et le cholate appartiennent également à cette catégorie bien qu’ils ne présentent pas d’extrémités chargées mais des groupes polaires distribués sur différentes parties de la chaine. Ils sont utilisés pour dissoudre les membranes. Du fait de leurs extrémités chargées, les détergents ioniques ne peuvent pas être éliminés par chromatographie d’échange d’ions.
Les détergents non-ioniques se distinguent des détergents ioniques par le fait que leur extrémité est non chargée et hydrophile. Ils sont considérés comme surfactants doux car ils dissolvent les interactions lipide-lipide et lipide-protéine mais pas les interactions protéine-protéine et la plupart ne dénature pas les protéines. De ce fait, les protéines sont solubilisées et isolées dans leur forme native et active, et retiennent leurs interactions protéiques. Ceci représente leur avantage principal et ils sont préférés dans les méthodes d’isolation de protéines membranaires.
Triton X-100 est l’exemple le plus caractéristique de surfactant non-ionique et le surfactant de choix pour la plupart des expériences d’immunoprécipitations. Tous les membres de la famille du Triton (Triton X100, Triton X114, Nonidet P40, Igepal® CA-630) sont relativement similaires et divergent seulement par leur nombre moyen (n) de monomères par micelle (9.6, 8.0, 9.0 and 9.5, respectivement) et dans la taille de l’extrémité PEG [4]. Le triton X100 dérive du polyoxyéthylène et contient un group hydrophobe alkylphényl. La CMC est faible et donc le triton n’est pas facilement éliminé par dialyse. La température de Cloud point est de 64oC et à cette température, la séparation de phase est observée.
Le n-dodecyl-β-D-maltoside (DDM) est un surfactant glycosidique de plus en plus utilisé dans l’isolation de protéines hydrophobiques et membranaires quand l’activité protéique doit être conservée. DDM est considéré plus efficace que d’autres surfactants tels que CHAPS ou NP-40 [5]. La chaine glycosidique dans son site lipophile, sa CMC élevée de 0.17 mM et l’interface des micelles créant un microenvironnement de type aqueux idéal pour solubiliser et retenir la stabilité des protéines membranaires et hydrophobes.
Extraite de la digitale violette (Digitalis purpurea), la digitonine est utilisé pour l’isolation des membranes plasmatique eucaryotes. Le sarkosyl et le Triton X-100 vont solubiliser les membranes internes bactériennes mais pas les membranes externes.
Le Tween-20 et le Tween-80 sont des surfactants polysorbique présentant un ester d'acide gras et une longue chaine de polyoxyéthylène. Ils présentent une CMC très basse et sont généralement des surfactants doux, ils n’affectent pas l’activité protéique et sont très efficace pour la solubilisation des protéines. Ils sont rarement utilisés dans les solutions de lyse cellulaire mais sont couramment utilisés en tant que détergents dans les tampons de lavage en Immunoblotting et en ELISA car ils aident à limiter les liaisons non spécifiques des anticorps et à éliminer les particules non liées. La plupart des détergents non-ioniques interfèrent avec la spectrophotométrie en ultra-violet (UV), surtout le Triton X100, car ils contiennent un anneau phényl et ils absorbent la lumière UV. De ce fait la quantification des protéines à 280nm serait inexacte.
Les extrémités des détergents Zwitterionique (ou amphotérique) sont hydrophile et présentent un nombre égal de charges positives et de charges négatives, résultant en une charge nette nulle. Ils sont généralement plus abrasifs que les surfactants non-ioniques. L’exemple le plus caractéristique est le 3- [(3-cholamidopropyl) dimethylammonio] -1-propanesulfonate, mieux connu sous le nom de CHAPS. Sa CMC élevée (6 mM à température ambiante) permet une élimination efficace par dialyse. CHAPS est communément utilisé dans la préparation d’échantillons à la concentration de 2-4% pour l’isoélectrofocalisation et électrophorèse 2D. CHAPSO est différent de CHAPS car il contient une extrémité plus polaire qui le rend plus soluble. Il est donc surtout utilisé pour la solubilisation des protéines membranaires intégrales.
Les agents chaotropes sont similaires aux surfactants. Ils rompent les interactions non-covalentes (ponts hydrogènes, interactions dipôle-dipôle, interactions hydrophobe) facilitant la dénaturation des protéines qui dans ce cas est généralement réversible. L’urée seule ou associée à la thio-urée ou d’autres détergents est l’agent chaotrope le plus souvent utilise pour des applications telles que l’électrophorèse 2D et dans les étapes de digestion enzymatique des protéines en solution pour les analyses protéomiques. Lorsque l’urée est utilisée des précautions supplémentaires doivent être prises pour éviter que l’échantillon soit exposé à des températures supérieures à 37oC qui conduirait à une carbamylation des protéines [6].
L’isolation des protéines membranaires est particulièrement intéressante car elle présente des problèmes différents par rapport à l’isolation des protéines nucléaires et cytosoliques. L'obstacle principal à la solubilisation des protéines membranaires en solution aqueuse est la nature complexe de la couche lipidique, leurs domaines hydrophiles et hydrophobes et leur faible niveau d’expression. Pour la solubilisation de protéines membranaires, un détergent avec une CMC élevée est préférable, le volume de solution est également crucial car suffisamment de détergent est nécessaire pour solubiliser toutes les protéines membranaires dans l’échantillon.
D’après Linke [2],au moins une micelle par protéine est nécessaire pour imiter l’environnement lipidique de la membrane (Fig. 1C-D). En principe, en changeant la température et la concentration en sel dans le tampon de lyse, une solubilisation efficace des protéines membranaires peut être atteinte en utilisant la séparation de phase. Dans ce cas, les protéines membranaires entourées par les micelles précipitent avec le détergent alors que les protéines solubles restent dans le surnageant. La température à laquelle la solution détergente se sépare en deux phases est appelée température de Cloud point. La température de Cloud point est affectée non seulement par la température mais aussi par des additifs dans le tampon de lyse tels que le glycérol ou les sels (e.g. Triton X114 a un Cloud point de 23oC mais en présence de 20% de glycérol, le Cloud point descend à 4oC). Ceci est très important quand la stabilité d’une protéine est affectée par des températures élevées.
Un bon détergent doit être capable de lyser les cellules, solubiliser les protéines et d’être approprié pour les applications qui suivent. La question suivante est le besoin d’une protéine soluble dans sa forme native ou dénaturée. Il n’existe pas de détergent idéal pour toutes les applications et même pour une application identique le résultat varie en fonction de la protéine d’intérêt (Table 2). Donc la meilleure stratégie est de tester plusieurs détergents ou un mélange de détergents. De plus, la préparation de solution détergente fraiche est généralement la meilleure approche pour éviter l’hydrolyse et l’oxydation.
| Détergent | MW (Da) monomère | MW (Da) micelle | CMC (mM) 25oC | Nombre d’Agrégation | Cloud Point (oC) | Poids micellaire moyen | force | Dialysable | Applications |
|---|---|---|---|---|---|---|---|---|---|
| SDS | 289 | 18,000 | 7-10 | 62 | >100 | 18,000 | abrasif | Oui | Lyse cellulaire, Electrophorèse, WB, hybridation |
| Triton X-100 | 625 | 90,000 | 0.2-0.9 | 100-155 | 65 | 80,000 | doux | Non | Enzyme immunoassays, IP, solubilisation Membranaire |
| CHAPS | 615 | 6,150 | 6 | 10 | >100 | 6,150 | doux | oui | IEF, IP |
| NP-40 | 680 | 90,000 | 0.059 | 45-50 | doux | Non | IEF | ||
| n-dodecyl-β-D-maltoside | 511 | 0.15 | 98 | 50,000 | Cristallisation de Proteine | ||||
| Tween-20 | 1228 | 0.06 | 76 | doux | Non | WB, ELISA, Enzyme immunoassays | |||
| Digitonine | 1229 | 70,000 | <0.5 | 60 | 70,000 | doux | Non | solubilisation Membranaire |
Les applications suivant la lyse cellulaire conditionnent non seulement le type de détergent choisi mais aussi sa concentration qui doit généralement être diminuée voir éliminée. Pour ce faire, la chromatographie d’exclusion ou la dialyse peuvent être utilisées mais pour cela la taille des micelles doit être différente de la taille de la protéine d’intérêt, ou bien les micelles doivent être de taille suffisamment petite (i.e. high CMC) pour passer au travers des pores du tube de dialyse [2]. D’autres méthodes utilisent des billes non-polaires ou des résines liant les détergents, composés d'inclusion de cyclo dextrine [7], chromatographie d’échange d’ions ou la précipitation de protéines. Cependant, le tampon final après l’élimination du détergents doit être choisi avec précaution afin d’éviter la précipitation et l’agrégation des protéines.
Labome a revu la littérature pour l’application des détergents. La table suivante répertorie les principaux fournisseurs et le nombre de publications, montrant que le fournisseur principal de détergents est Sigma Aldrich.
| détergent | num | Fournisseurs |
|---|---|---|
| Triton X-100 | 30 | Thermo Fisher, Amresco, JT Baker, Packard, Sigma |
| Tween-20 | 17 | Thermo Fisher, Amersham Pharmacia, Bio-Rad |
| SDS | 13 | Amresco, Bio-Rad, Q.BIOgene, Sigma |
| NP-40 | 5 | Roche, Sigma |
| CHAPS | 5 | EMD Millipore/Merck/Calbiochem, Sigma, JT Baker |
| digitonin | 4 | EMD Millipore/Merck, Sigma |
Le Triton X-100 de Thermo Fisher Pierce a été utilisé pour la lyse de cellules et d’échantillons tissulaires pour western blots [8] [9]. Le TritonX-100 30% d’Amresco a été utilisé pour homogénéiser des cordes spinales de rats [10]. Le Triton X-100 de JT Baker a été utilisé pour fixer et perméabiliser des cellules pour la visualisation du cytosquelette d’actine [11]. Le Triton-X de Packard a été utilisé pour dissoudre des anticorps primaires pour des techniques d’immunocytochimie [12]. Le Triton X-100 de Sigma a été utilisé pour perméabiliser des cellules en immunocytochimie [13] [14] [15] [16] [17] [18] [19] [20] [21], ou dans le tampon de blocage pour l’immunohistochimie [22] [23], pour solubiliser des échantillons en western blots [25] [26],pour lyser des échantillons de cellules et tissues [27] [28] [29] [30] [31] [32] [33], en PCR [34], expérience de fusion des liposomes [35], et dans les expériences d’immunohistochimie en « whole mount » [36].
Le Tween-20 est généralement utilisé dans les tampons de lavage tels que le TBS-T, PBS-T, dans différentes techniques immunologiques.Le 0.05% Tween de Fisher a été utilisé en ELISA [38]. Le Tween 20 d’Amersham Pharmacia a été utilisé en western blot [27] et pour le lavage des sections de tissu en immunohistochimie [39]. Le Tween-20 de Sigma a été utilisé pour les solutions de lavage de western blot [26] [15], [40], [41], [42] [43], en ELISA [46] [47], en immunoprécipitation [48], en in situ hybridation [49], et dans les matrice micro fluidique de PCR multiplexes [50] et autres [51] [52].
Le SDS d’Amresco a été utilisé en SDS-PAGE [53]. Le sodium dodecyl sulfate de Bio-Rad a été utilisé pour la préparation du tampon de radioimmunoprécipitation (RIPA) [54]. Le SDS de Q.BIOgene a été utilisé pour préparer des tampons d’homogénéisation des précipités pour western blots [55]. Le SDS de SIGMA a été utilisé pour préparer des tampon pour, entre autre, les tests d’octanoylation in vitro, le tampon d’échantillon Laemmli, les expériences 2D-DIGE [56] [26] [57] [29] [51] [58] [59] [60] [61]. Le SDS 10% de Sigma a été utilisé pour homogénéiser des cordes spinales de rats [10].
Le NP-40 de Roche a été utilisé pour la lyse cellulaire [62] [63], Le NP-40 de Sigma a été utilisé pour la préparation du tampon de radioimmunoprécipitation (RIPA) [54] [64], tampon de lyse cellulaire [21]. |
Le CHAPS (2% w/v) de Calbiochem a été utilisé dans le but d’identifier des protéines marqueurs du cancer de l’ovaire [37]. Le CHAPS de Sigma a été utilisé dans les tampons pour la purification de la proghrelin recombinante murine [57], l’immunoprécipitation [21], et la lyse de tissu [65]. Le CHAPS de JT Baker a été utilisé pour la lyse cellulaire pour étudier l’interaction de virus avec la protéine ASF1 [66].
La digitonine de MERCK a été utilisée en immunocytochimie pour étudier le rôle de PI4P dans l’identité de la membrane plasmique [67]. La digitonine de Sigma a été utilisée pour perméabiliser des cellules afin d’étudier la réponse des cellules mésenchymateuses et épithéliales à la Shiga toxine 1 d’Escherichia coli [68],pour étudier l’autophagie [69], et pour préparer le tampon d’extraction pour étudier l’effet de TNFalpha sur les macrophages [70].
Pour la purification de protéine, le n-decyl-beta-D-maltopyranoside d’Anatrace a été utilisé à 5 mM [74], le n-octyl-beta-D-glucopyranoside de Glycon [35], le octyl glucose neopentyl glycol (OGNPG) de Affymetrix à 1 % [76], et le cholesteryl hemisuccinate de Sigma à 0.1% (w/v) [77].
- Chae P, Rasmussen S, Rana R, Gotfryd K, Chandra R, Goren M, et al. Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nat Methods. 2010;7:1003-8 PMID 21037590 CrossRef
- Linke D. Detergents: an overview. Methods Enzymol. 2009;463:603-17 PMID 19892194 CrossRef
- Suzuki H, Terada T. Removal of dodecyl sulfate from protein solution. Anal Biochem. 1988;172:259-63 PMID 3189769
- Arnold T, Linke D. Phase separation in the isolation and purification of membrane proteins. Biotechniques. 2007;43:427-30, 432, 434 passim PMID 18019333
- Luche S, Santoni V, Rabilloud T. Evaluation of nonionic and zwitterionic detergents as membrane protein solubilizers in two-dimensional electrophoresis. Proteomics. 2003;3:249-53 PMID 12627377
- Rabilloud T. Detergents and chaotropes for protein solubilization before two-dimensional electrophoresis. Methods Mol Biol. 2009;528:259-67 PMID 19153698 CrossRef
- Degrip W, VanOostrum J, Bovee-Geurts P. Selective detergent-extraction from mixed detergent/lipid/protein micelles, using cyclodextrin inclusion compounds: a novel generic approach for the preparation of proteoliposomes. Biochem J. 1998;330:667-74 PMID 9480873
- Iqbal J, Dai K, Seimon T, Jungreis R, Oyadomari M, Kuriakose G, et al. IRE1beta inhibits chylomicron production by selectively degrading MTP mRNA. Cell Metab. 2008;7:445-55 PMID 18460335 CrossRef
- Qian Y, Chan A, Madhavan R, Peng H. The function of Shp2 tyrosine phosphatase in the dispersal of acetylcholine receptor clusters. BMC Neurosci. 2008;9:70 PMID 18647419 CrossRef
- Zhou H, Yang H, Li Y, Wang Y, Yan L, Guo X, et al. Changes in Glial cell line-derived neurotrophic factor expression in the rostral and caudal stumps of the transected adult rat spinal cord. Neurochem Res. 2008;33:927-37 PMID 18095158
- Krady M, Zeng J, Yu J, MacLauchlan S, Skokos E, Tian W, et al. Thrombospondin-2 modulates extracellular matrix remodeling during physiological angiogenesis. Am J Pathol. 2008;173:879-91 PMID 18688033 CrossRef
- Saito H, Dahlin L. Expression of ATF3 and axonal outgrowth are impaired after delayed nerve repair. BMC Neurosci. 2008;9:88 PMID 18801180 CrossRef
- Kalayda G, Wagner C, Buss I, Reedijk J, Jaehde U. Altered localisation of the copper efflux transporters ATP7A and ATP7B associated with cisplatin resistance in human ovarian carcinoma cells. BMC Cancer. 2008;8:175 PMID 18565219 CrossRef
- Kami D, Shiojima I, Makino H, Matsumoto K, Takahashi Y, Ishii R, et al. Gremlin enhances the determined path to cardiomyogenesis. PLoS ONE. 2008;3:e2407 PMID 18545679 CrossRef
- Li B, Du T, Li H, Gu L, Zhang H, Huang J, et al. Signalling pathways for transactivation by dexmedetomidine of epidermal growth factor receptors in astrocytes and its paracrine effect on neurons. Br J Pharmacol. 2008;154:191-203 PMID 18311185 CrossRef
- Lavender V, Chong S, Ralphs K, Wolstenholme A, Reaves B. Increasing the expression of calcium-permeable TRPC3 and TRPC7 channels enhances constitutive secretion. Biochem J. 2008;413:437-46 PMID 18452405 CrossRef
- Burdak-Rothkamm S, Rothkamm K, Prise K. ATM acts downstream of ATR in the DNA damage response signaling of bystander cells. Cancer Res. 2008;68:7059-65 PMID 18757420 CrossRef
- Béaslas O, Cueille C, Delers F, Chateau D, Chambaz J, Rousset M, et al. Sensing of dietary lipids by enterocytes: a new role for SR-BI/CLA-1. PLoS ONE. 2009;4:e4278 PMID 19169357 CrossRef
- Harduf H, Goldman S, Shalev E. Progesterone receptor A and c-Met mediates spheroids-endometrium attachment. Reprod Biol Endocrinol. 2009;7:14 PMID 19220894 CrossRef
- Cheong R, Rhee A, Wang C, Nemenman I, Levchenko A. Information transduction capacity of noisy biochemical signaling networks. Science. 2011;334:354-8 PMID 21921160 CrossRef
- Peralta-Ramirez J, Hernandez J, Manning-Cela R, Luna-Munoz J, Garcia-Tovar C, Nougayrede J, et al. EspF Interacts with nucleation-promoting factors to recruit junctional proteins into pedestals for pedestal maturation and disruption of paracellular permeability. Infect Immun. 2008;76:3854-68 PMID 18559425 CrossRef
- Campbell C, Piper M, Plachez C, Yeh Y, Baizer J, Osinski J, et al. The transcription factor Nfix is essential for normal brain development. BMC Dev Biol. 2008;8:52 PMID 18477394 CrossRef
- Sousa A, Andrade L, Salles F, Pillai A, Buttermore E, Bhat M, et al. The septate junction protein caspr is required for structural support and retention of KCNQ4 at calyceal synapses of vestibular hair cells. J Neurosci. 2009;29:3103-8 PMID 19279247 CrossRef
- Fang S, Wei J, Pentinmikko N, Leinonen H, Salven P. Generation of functional blood vessels from a single c-kit+ adult vascular endothelial stem cell. PLoS Biol. 2012;10:e1001407 PMID 23091420 CrossRef
- Liew C, Shah N, Briston S, Shepherd R, Khoo C, Dunne M, et al. PAX4 enhances beta-cell differentiation of human embryonic stem cells. PLoS ONE. 2008;3:e1783 PMID 18335054 CrossRef
- Dilly A, Rajala R. Insulin growth factor 1 receptor/PI3K/AKT survival pathway in outer segment membranes of rod photoreceptors. Invest Ophthalmol Vis Sci. 2008;49:4765-73 PMID 18566464 CrossRef
- Bonneh-Barkay D, Bissel S, Wang G, Fish K, Nicholl G, Darko S, et al. YKL-40, a marker of simian immunodeficiency virus encephalitis, modulates the biological activity of basic fibroblast growth factor. Am J Pathol. 2008;173:130-43 PMID 18556781 CrossRef
- Dianzani C, Brucato L, Gallicchio M, Rosa A, Collino M, Fantozzi R. Celecoxib modulates adhesion of HT29 colon cancer cells to vascular endothelial cells by inhibiting ICAM-1 and VCAM-1 expression. Br J Pharmacol. 2008;153:1153-61 PMID 18084316
- Chung Y, Troy H, Kristeleit R, Aherne W, Jackson L, Atadja P, et al. Noninvasive magnetic resonance spectroscopic pharmacodynamic markers of a novel histone deacetylase inhibitor, LAQ824, in human colon carcinoma cells and xenografts. Neoplasia. 2008;10:303-13 PMID 18392140
- Sasaki G, Ishii T, Jeyasuria P, Jo Y, Bahat A, Orly J, et al. Complex role of the mitochondrial targeting signal in the function of steroidogenic acute regulatory protein revealed by bacterial artificial chromosome transgenesis in vivo. Mol Endocrinol. 2008;22:951-64 PMID 18187601 CrossRef
- Auffray C, Fogg D, Narni-Mancinelli E, Senechal B, Trouillet C, Saederup N, et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. J Exp Med. 2009;206:595-606 PMID 19273628 CrossRef
- Sha Y, Pandit L, Zeng S, Eissa N. A critical role for CHIP in the aggresome pathway. Mol Cell Biol. 2009;29:116-28 PMID 18955503 CrossRef
- Mitchell R, Lee S, Randazzo W, Simmons Z, Connor J. Influence of HFE variants and cellular iron on monocyte chemoattractant protein-1. J Neuroinflammation. 2009;6:6 PMID 19228389 CrossRef
- Wochner A, Attwater J, Coulson A, Holliger P. Ribozyme-catalyzed transcription of an active ribozyme. Science. 2011;332:209-12 PMID 21474753 CrossRef
- Hernandez J, Stein A, Behrmann E, Riedel D, Cypionka A, Farsi Z, et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 2012;336:1581-4 PMID 22653732 CrossRef
- Schulz C, Gomez Perdiguero E, Chorro L, Szabo-Rogers H, Cagnard N, Kierdorf K, et al. A lineage of myeloid cells independent of Myb and hematopoietic stem cells. Science. 2012;336:86-90 PMID 22442384 CrossRef
- Scholler N, Gross J, Garvik B, Wells L, Liu Y, Loch C, et al. Use of cancer-specific yeast-secreted in vivo biotinylated recombinant antibodies for serum biomarker discovery. J Transl Med. 2008;6:41 PMID 18652693 CrossRef
- Lam W, Tang J, Yeung A, Chiu L, Sung J, Chan P. Avian influenza virus A/HK/483/97(H5N1) NS1 protein induces apoptosis in human airway epithelial cells. J Virol. 2008;82:2741-51 PMID 18199656 CrossRef
- Stoikos C, Harrison C, Salamonsen L, Dimitriadis E. A distinct cohort of the TGFbeta superfamily members expressed in human endometrium regulate decidualization. Hum Reprod. 2008;23:1447-56 PMID 18434375 CrossRef
- Gulati P, Gaspers L, Dann S, Joaquin M, Nobukuni T, Natt F, et al. Amino acids activate mTOR complex 1 via Ca2+/CaM signaling to hVps34. Cell Metab. 2008;7:456-65 PMID 18460336 CrossRef
- Habashi J, Doyle J, Holm T, Aziz H, Schoenhoff F, Bedja D, et al. Angiotensin II type 2 receptor signaling attenuates aortic aneurysm in mice through ERK antagonism. Science. 2011;332:361-5 PMID 21493863 CrossRef
- Holm T, Habashi J, Doyle J, Bedja D, Chen Y, Van Erp C, et al. Noncanonical TGFβ signaling contributes to aortic aneurysm progression in Marfan syndrome mice. Science. 2011;332:358-61 PMID 21493862 CrossRef
- Carbone D, Moreno J, Tjalkens R. Nuclear factor kappa-B mediates selective induction of neuronal nitric oxide synthase in astrocytes during low-level inflammatory stimulation with MPTP. Brain Res. 2008;1217:1-9 PMID 18508038 CrossRef
- Walser R, Burke J, Gogvadze E, Bohnacker T, Zhang X, Hess D, et al. PKCβ Phosphorylates PI3Kγ to Activate It and Release It from GPCR Control. PLoS Biol. 2013;11:e1001587 PMID 23824069 CrossRef
- Diao J, Burré J, Vivona S, Cipriano D, Sharma M, Kyoung M, et al. Native α-synuclein induces clustering of synaptic-vesicle mimics via binding to phospholipids and synaptobrevin-2/VAMP2. elife. 2013;2:e00592 PMID 23638301 CrossRef
- Castilow E, Olson M, Meyerholz D, Varga S. Differential role of gamma interferon in inhibiting pulmonary eosinophilia and exacerbating systemic disease in fusion protein-immunized mice undergoing challenge infection with respiratory syncytial virus. J Virol. 2008;82:2196-207 PMID 18094193
- Rasooly R, Do P. Development of an in vitro activity assay as an alternative to the mouse bioassay for Clostridium botulinum neurotoxin type A. Appl Environ Microbiol. 2008;74:4309-13 PMID 18515481 CrossRef
- Duong H, Robles M, Knutti D, Weitz C. A molecular mechanism for circadian clock negative feedback. Science. 2011;332:1436-9 PMID 21680841 CrossRef
- Miyagawa Y, Okita H, Itagaki M, Toyoda M, Katagiri Y, Fujimoto J, et al. EWS/ETS regulates the expression of the Dickkopf family in Ewing family tumor cells. PLoS ONE. 2009;4:e4634 PMID 19247449 CrossRef
- Tadmor A, Ottesen E, Leadbetter J, Phillips R. Probing individual environmental bacteria for viruses by using microfluidic digital PCR. Science. 2011;333:58-62 PMID 21719670 CrossRef
- Giannopoulou M, Dai C, Tan X, Wen X, Michalopoulos G, Liu Y. Hepatocyte growth factor exerts its anti-inflammatory action by disrupting nuclear factor-kappaB signaling. Am J Pathol. 2008;173:30-41 PMID 18502824 CrossRef
- Osterloh J, Yang J, Rooney T, Fox A, Adalbert R, Powell E, et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 2012;337:481-4 PMID 22678360 CrossRef
- Wang F, Wang X, Yuan C, Ma J. Generating a prion with bacterially expressed recombinant prion protein. Science. 2010;327:1132-5 PMID 20110469 CrossRef
- Che X, Reichelt M, Sommer M, Rajamani J, Zerboni L, Arvin A. Functions of the ORF9-to-ORF12 gene cluster in varicella-zoster virus replication and in the pathogenesis of skin infection. J Virol. 2008;82:5825-34 PMID 18400847 CrossRef
- Campos-Toimil M, Keravis T, Orallo F, Takeda K, Lugnier C. Short-term or long-term treatments with a phosphodiesterase-4 (PDE4) inhibitor result in opposing agonist-induced Ca(2+) responses in endothelial cells. Br J Pharmacol. 2008;154:82-92 PMID 18311187 CrossRef
- Amsili S, Zer H, Hinderlich S, Krause S, Becker-Cohen M, MacArthur D, et al. UDP-N-acetylglucosamine 2-epimerase/N-acetylmannosamine kinase (GNE) binds to alpha-actinin 1: novel pathways in skeletal muscle?. PLoS ONE. 2008;3:e2477 PMID 18560563 CrossRef
- Yang J, Zhao T, Goldstein J, Brown M. Inhibition of ghrelin O-acyltransferase (GOAT) by octanoylated pentapeptides. Proc Natl Acad Sci U S A. 2008;105:10750-5 PMID 18669668 CrossRef
- Simon S, Nugier J, Morel N, Boutal H, Creminon C, Benestad S, et al. Rapid typing of transmissible spongiform encephalopathy strains with differential ELISA. Emerg Infect Dis. 2008;14:608-16 PMID 18394279 CrossRef
- Salvi A, Bongarzone I, Miccichè F, Arici B, Barlati S, De Petro G. Proteomic identification of LASP-1 down-regulation after RNAi urokinase silencing in human hepatocellular carcinoma cells. Neoplasia. 2009;11:207-19 PMID 19177205
- Lin I, Miller D, Bertics P, Murphy C, de Pablo J, Abbott N. Endotoxin-induced structural transformations in liquid crystalline droplets. Science. 2011;332:1297-300 PMID 21596951 CrossRef
- Gatto M, Drudi-Metalli V, Torrice A, Alpini G, Cantafora A, Blotta I, et al. Insulin-like growth factor-1 isoforms in rat hepatocytes and cholangiocytes and their involvement in protection against cholestatic injury. Lab Invest. 2008;88:986-94 PMID 18607346 CrossRef
- Mayer A, Heidemann M, Lidschreiber M, Schreieck A, Sun M, Hintermair C, et al. CTD tyrosine phosphorylation impairs termination factor recruitment to RNA polymerase II. Science. 2012;336:1723-5 PMID 22745433 CrossRef
- Lu B, PereiraPerrin M. A novel immunoprecipitation strategy identifies a unique functional mimic of the glial cell line-derived neurotrophic factor family ligands in the pathogen Trypanosoma cruzi. Infect Immun. 2008;76:3530-8 PMID 18541656 CrossRef
- Slipicevic A, Jørgensen K, Skrede M, Rosnes A, Trøen G, Davidson B, et al. The fatty acid binding protein 7 (FABP7) is involved in proliferation and invasion of melanoma cells. BMC Cancer. 2008;8:276 PMID 18826602 CrossRef
- Lamming D, Ye L, Katajisto P, Goncalves M, Saitoh M, Stevens D, et al. Rapamycin-induced insulin resistance is mediated by mTORC2 loss and uncoupled from longevity. Science. 2012;335:1638-43 PMID 22461615 CrossRef
- Ambagala A, Bosma T, Ali M, Poustovoitov M, Chen J, Gershon M, et al. Varicella-zoster virus immediate-early 63 protein interacts with human antisilencing function 1 protein and alters its ability to bind histones h3.1 and h3.3. J Virol. 2009;83:200-9 PMID 18971269 CrossRef
- Hammond G, Fischer M, Anderson K, Holdich J, Koteci A, Balla T, et al. PI4P and PI(4,5)P2 are essential but independent lipid determinants of membrane identity. Science. 2012;337:727-30 PMID 22722250 CrossRef
- Stamm I, Mohr M, Bridger P, Schröpfer E, König M, Stoffregen W, et al. Epithelial and mesenchymal cells in the bovine colonic mucosa differ in their responsiveness to Escherichia coli Shiga toxin 1. Infect Immun. 2008;76:5381-91 PMID 18765725 CrossRef
- Altman B, Wofford J, Zhao Y, Coloff J, Ferguson E, Wieman H, et al. Autophagy provides nutrients but can lead to Chop-dependent induction of Bim to sensitize growth factor-deprived cells to apoptosis. Mol Biol Cell. 2009;20:1180-91 PMID 19109422 CrossRef
- Tran T, Temkin V, Shi B, Pagliari L, Daniel S, Ferran C, et al. TNFalpha-induced macrophage death via caspase-dependent and independent pathways. Apoptosis. 2009;14:320-32 PMID 19152111 CrossRef
- McCoy W, Wang X, Yokoyama W, Hansen T, Fremont D. Structural mechanism of ER retrieval of MHC class I by cowpox. PLoS Biol. 2012;10:e1001432 PMID 23209377 CrossRef
- Lee B, Moon J, Shu J, Yuan L, Newman Z, Schekman R, et al. UNC93B1 mediates differential trafficking of endosomal TLRs. elife. 2013;2:e00291 PMID 23426999 CrossRef
- Kudryashev M, Stenta M, Schmelz S, Amstutz M, Wiesand U, Castaño-Diez D, et al. In situ structural analysis of the Yersinia enterocolitica injectisome. elife. 2013;2:e00792 PMID 23908767 CrossRef
- Miller A, Long S. Crystal structure of the human two-pore domain potassium channel K2P1. Science. 2012;335:432-6 PMID 22282804 CrossRef
- Schulz S, Iglesias-Cans M, Krah A, Yildiz O, Leone V, Matthies D, et al. A new type of na(+)-driven ATP synthase membrane rotor with a two-carboxylate ion-coupling motif. PLoS Biol. 2013;11:e1001596 PMID 23824040 CrossRef
- Kellosalo J, Kajander T, Kogan K, Pokharel K, Goldman A. The structure and catalytic cycle of a sodium-pumping pyrophosphatase. Science. 2012;337:473-6 PMID 22837527 CrossRef
- Xu F, Wu H, KATRITCH V, Han G, Jacobson K, Gao Z, et al. Structure of an agonist-bound human A2A adenosine receptor. Science. 2011;332:322-7 PMID 21393508 CrossRef